Loi de Charles
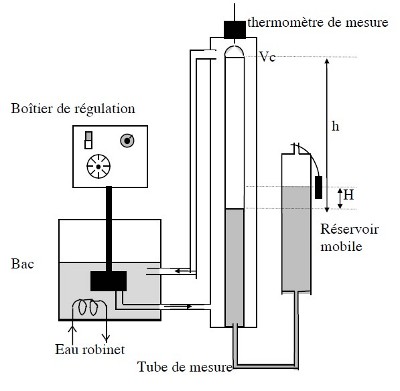
Descriptif du matériel utilisé
Dans un tube de mesure M on a introduit de l'air sec emprisonné par une colonne de mercure; la section S du tube est constante. Le volume d'air enfermé par le mercure est donc:
En outre un réservoir mobile rempli de mercure est relié au tube de mercure par un tube souple. La pression dans le tube de mercure est donc égale à:
La pression extérieure
Section du tube de mesure:
Volume de la calotte sphérique
Observations
Du fait des phénomènes de tension superficielle il se forme un ménisque à l'interface verre-mercure. Avant chaque mesure manoeuvrer le réservoir mobile de façon à toujours avoir le même aspect du ménisque.
Le tube de mercure est entouré d'une gaine dans laquelle on peut faire circuler de l'eau à température constante. La pompe du thermostat fonctionne dès que celui-ci est sous tension.
Pour refroidir plus rapidement le bain, on peut faire circuler doucement de l'eau froide dans le serpentin échangeur qui est placé dans la cuve.
Pour des raisons de sécurité (émission de vapeurs de mercure toujours possibles), il est interdit de dépasser 70°C.
Un bouchon permet de fermer le réservoir lorsqu'il n'est pas utilisé (à cause des vapeurs de mercure éventuelles). Ne pas oublier de le retirer lors des mesures.
Schéma du montage
Consignes pour la prise de mesure
Régler la température du bain au moyen du bouton gradué et noter la température sur le thermomètre situé au dessus du tube de mercure et non sur le boîtier de régulation.
Attendre avant de faire une mesure que le voyant de chauffage se mette à clignoter: cela signifie que la température de consigne est atteinte et que la température du bain est stable.
Prise de mesure
Dans ce cas le volume doit être constant, on calculera la hauteur h qu'il faudra maintenir pour chaque mesure afin que le volume total soit voisin de (y compris
).
A partir de la température maximum de 70°C que vous venez d'atteindre dans l'expérience précédente, faites décroître T par sauts de 5°C, jusqu'à T=27°C.
Pour chaque valeur de la température déterminer la pression du gaz enfermé.
T.P. rédigé par Anne Désert
Photos réalisées par Guillaume Isaac
Exploitation des résultats
Tracer .
Conclure sur la validité de la loi de Charles.
Déterminer le coefficient directeur de la droite correspondant au coefficient d'augmentation de pression isochore.
Comparer à sa valeur théorique pour un gaz parfait.
Déduire de l'ensemble des mesures le coefficient de compressibilité isotherme.